Das Kurzdarmsyndrom mit chronischem Darmversagen ist eine lebensbedrohende Erkrankung des Intestinaltrakts und zählt mit einer geschätzten Prävalenz von 3,4/100.000 Personen zu den seltenen Erkrankungen. (2) Ursache ist meist die Resektion großer Darmabschnitte, welche die Absorption adäquater Mengen von Makro- und Mikronährstoffen, Elektrolyten und Wasser stark verringert. (3) Dies kann unter anderem zu Diarrhö, Dehydration und Mangelernährung führen. Einige Patienten mit Kurzdarmsyndrom sind langfristig auf parenterale Ernährung und Flüssigkeitszufuhr (parenterale Supplementation; PS) angewiesen. (3) Mit Teduglutid (Revestive®), einem Analogon von Glucagon-like Peptid 2 (GLP-2), steht eine Therapieoption für Patienten mit Kurzdarmsyndrom ab dem Alter von einem Jahr zur Verfügung, mit der der PS-Bedarf gesenkt werden kann bzw. im Idealfall Patienten von PS unabhängig werden. (1)
Klassifikation/Ursachen
Folgende Kriterien werden für die Klassifikation des Kurzdarmsyndroms herangezogen:
- Ursachen für ein Kurzdarmsyndrom
- Postoperative Anatomie
- Postchirugischer Outcome (Typ I, II, III)
- Absorptive Kapazität des verbleibenden Darmes
1. Ursachen für das Kurzdarmsyndrom bei Erwachsenen sind häufig
- ausgedehnte Darmresektionen, indiziert durch M. Crohn, schwerwiegende vaskulären Ereignisse im Bereich des Mesenteriums (Thrombose, Embolie), Trauma und Volvulus,
- Komplikationen einer bariatrischen Chirurgie,
- Bestrahlungsenteritis,
- Komplikationen nach wiederholten Bauchoperationen,
- rezidivierende intestinale Pseudo-Obstruktion und
- Zottenatrophie. (3)
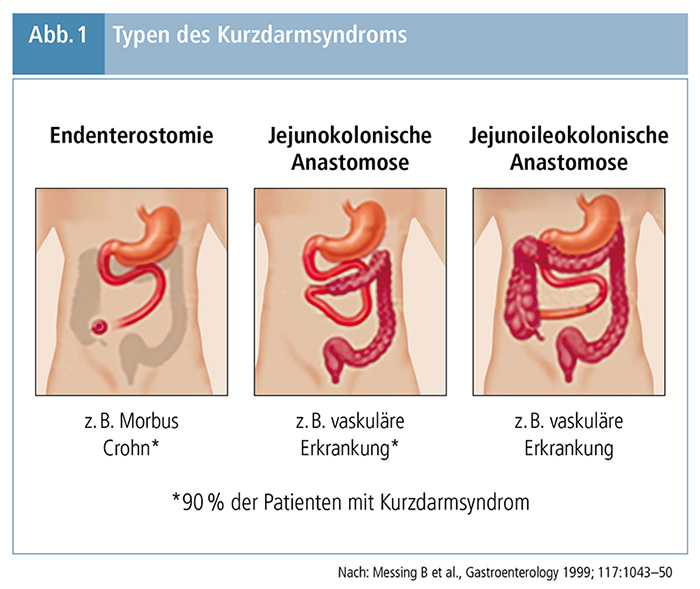
2. Postoperative Anatomie: In Abbildung 1 sind die drei anatomischen Typen des Kurzdarmsyndroms, Endenterostomie (z. B. aufgrund von M. Crohn), jejunokolonische Anastomose (z. B. aufgrund von vaskulären Ereignissen) und jejunoileo kolonische Anastomose (z. B. aufgrund von vaskulären Ereignissen) dargestellt. (4) Da die Darmlänge von Erwachsenen variiert, liefert die Länge des verbliebenen Darms mehr Information als die Länge des resezierten Darmabschnitts. Erwachsene Patienten, bei denen weniger als ein Drittel des jejuno-ilealen Segments (≤200 cm) verbleibt, entwickeln typischerweise Symptome des Kurzdarmsyndroms. Patienten ohne funktionelles Kolon und einer Dünndarmlänge <100 cm sowie Patienten mit funktionellem Kolon und einer Dünndarmlänge <60 cm bleiben in der Regel von PS abhängig. (3)
3. Postchirurgischer Outcome: Basierend auf dem Beginn der Erkrankung sowie metabolischen Kriterien und dem zu erwartenden Outcome können folgende Typen des Kurzdarmsyndroms mit chronischem Darmversagen unterschieden werden:
- Typ I: akuter, kurzzeitiger und oft selbstlimitierender Zustand, der für einige Tage eine PS im postoperativen Setting meist auf der Intensivstation erfordert.
- Typ II: verlängerter akuter Zustand, oft bei meta bolisch instabilen Patienten, der eine komplexe multidisziplinäre Betreuung und eine PS über Wochen oder Monate erfordert.
- Typ III: chronischer Zustand, oft bei metabolisch stabilen Patienten, der eine PS über Monate oder Jahre erfordert. Dieser Zustand kann reversibel oder irreversibel sein. (5)
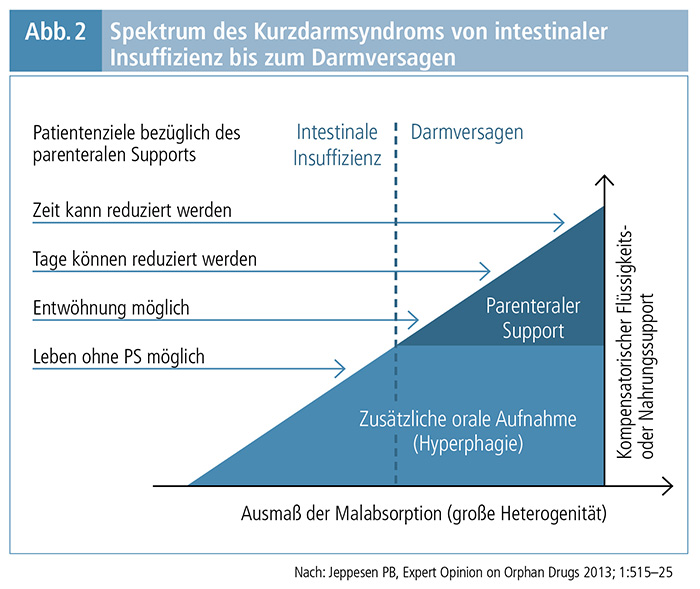
4. Absorptive Kapazität des verbleibenden Darmes: Der Anteil der absorbierten Nahrung und Flüssigkeit charakterisiert das Ausmaß der intestinalen Insuffizienz noch besser als die Darm länge. Das Spektrum reicht von intestinaler Insuffizienz bis zum Darmversagen (Abb. 2). (3, 6) Unter intestinaler Insuffizienz wird eine Verringerung der Absorptionskapazität des Darms verstanden, die zur Aufrechterhaltung der Gesundheit bzw. des Wachstums keine parenterale Supplementation erforderlich macht. Beim Darmversagen ist die Darmfunktion so stark herabgesetzt, dass keine ausreichende Absorption von Makronährstoffen und/oder von Wasser und Elektrolyten möglich ist und eine PS nötig wird. (6)
Auswirkungen
Sowohl die Auswirkungen als auch die Prognose eines Kurzdarmsyndroms variieren je nach Ausmaß des Darmverlusts, der Anatomie des resezierten Darmteils und der Fähigkeit des verbliebenen Darms, den Verlust funktionell zu kompensieren. (3) Eine chronische Nährstoffunterversorgung kann zu Gewichtsverlust und Zeichen einer Unterernährung, wie erniedrigter Körpertemperatur, ge störtem Wachstum und gestörter Sexualentwicklung führen. (3) Mögliche Folgen eines durch Unterernährung bedingten Gewichtsverlusts sind Verwirrtheit, Konzentrationsstörungen, Somnolenz und Schwächegefühl. Viele Betroffene berichten von Apathie, Depression und Gereiztheit, welche unter anderem auch die Rekonvaleszenz beeinträchtigen können. Auch Hypotonie, Niereninsuffizienz und gestörte Wundheilung sind mögliche Konsequenzen. (3) Darüber hinaus haben Patienten mit Kurzdarmsyndrom eine geringere Lebenserwartung und eine geringere gesundheitsbezogene Lebensqualität als die Allgemeinbevölkerung. (3)
Adaption des Darms
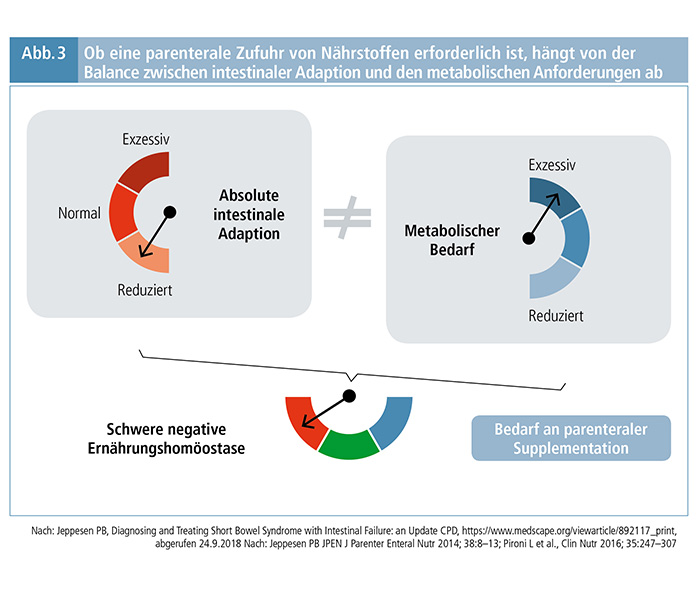
Der Darm hat innerhalb von zwei Jahren nach einer ausgedehnten Darmresektion das Potenzial, funktionell zu adaptieren, weitere Verbesserungen darüber hinaus sind selten. (3) Ob eine PS erforderlich ist bzw. bleibt, hängt von der Balance zwischen intestinaler Adaption und den metabolischen Anforderungen ab. Bei normaler absoluter intestinaler Adaption und normalem metabolischem Bedarf ist keine PS erforderlich. Patienten mit verringerter absoluter intestinaler Adaption und gleichzeitig erhöhtem metabolischem Bedarf können hingegen eine schwere metabolische Dysbalance entwickeln, die eine PS erfordert (Abb. 3).
Therapieziele und Therapiestrategien
Die Therapie des Kurzdarmsyndroms mit chronischem Darmversagen erfordert eine multidisziplinäre und multiprofessionelle Expertise und interdisziplinäre Kooperation (Abb. 4). (8)
Hauptziele sind
- die Maximierung der Adaption des verbliebenen Darms durch Förderung der Absorptionskapazität
- die Minimierung der Symptomatik der Malabsorption wie Diarrhö, Meteorismus, Abdominalschmerzen und Stomaprobleme
- die Verringerung des PS-Bedarfs oder idealerweise das dauerhafte Absetzen der PS, um die tägliche Belastung durch die Erkrankung zu reduzieren und auch das Risiko für PS-assoziierte Komplikationen (Katheter-assoziierte Sepsis, zentralvenöse Thrombose/Embolie, progressive Leber- und Nierenerkrankung aufgrund von Darmversagen) zu minimieren (6, 9)
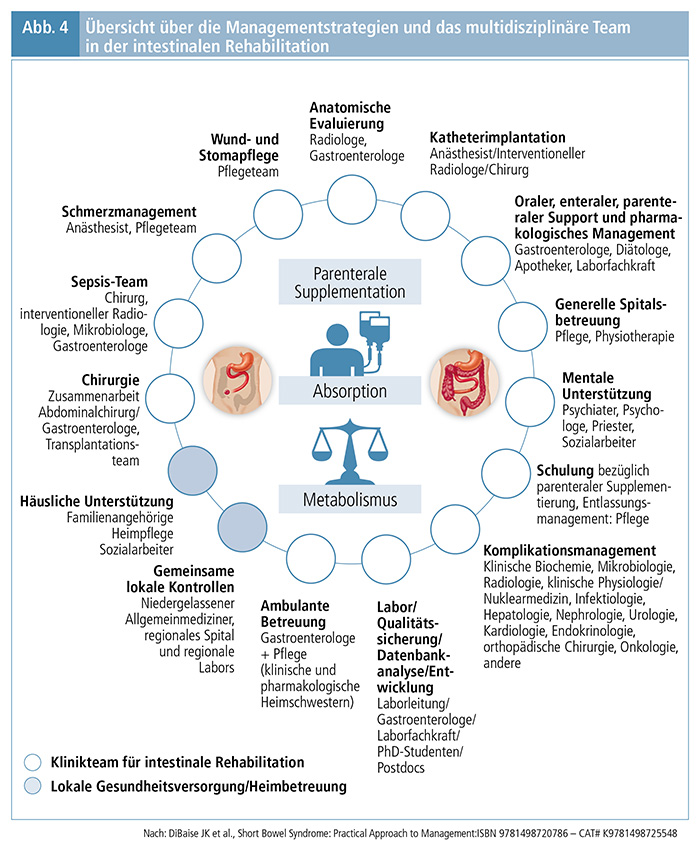
Zur intestinalen Rehabilitation werden drei Strategien verfolgt:
- die Unterstützung der spontanen Adaptation durch orale Rehydratationslösungen und diätetische Intervention,
- die konventionelle pharmakologische Hyperadaptation durch antisekretorisch wirksame Substanzen und Antidiarrhoika und
- die hormonelle Hyperadaptation durch proabsorptive Mediatoren wie Teduglutid (9)
Die von der European Society for Clinical Nutrition and Metabolism (ESPEN) formulierten generellen Handlungsempfehlungen sind in Tabelle 1 zusammengefasst. (5)

Hormonelle Therapie des Kurzdarmsyndroms mit GLP-2
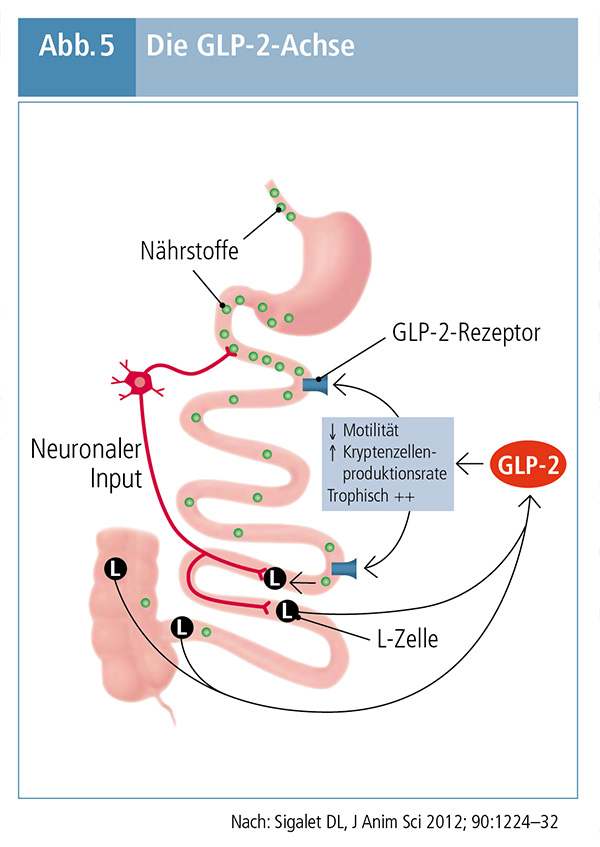
In den letzten Jahren wurde erkannt, dass die Malabsorption im Rahmen des Kurzdarmsyndroms nicht nur durch die verringerte Absorptionsoberfläche bedingt ist, sondern auch durch veränderte neuroendokrine Interaktion und Veränderungen der Magenmotilität, der Sekretion im Bereich von Magen und Darm, der Perfusion, Morphologie/Histologie und der Permeabilität sowie der Immun- und Barrierefunktion des Darms wie auch durch eine gestörte Reparation und Adaptation der Mukosa. Dies hat zur Überlegung geführt, die Absorptionskapazität des verbliebenen Darms durch hormonelle Faktoren zu erhöhen und so den Nährstoff- und Flüssigkeitsverlust und damit auch den PS-Bedarf zu verringern. (5)
Ein solcher hormoneller Faktor ist Glucagonlike Peptide 2 (GLP-2), das nach Nahrungsaufnahme von den L-Zellen des Darms sezerniert wird und die Pathophysiologie des Kurzdarmsyndroms günstig beeinflusst. Die Gabe von GLP-2
- stimuliert die mesenteriale Perfusion
- aktiviert proabsorptive Signalwege
- verbessert die Nährstoffabsorption
- stärkt die Barrierefunktion des Darms
- induziert proliferative und zytoprotektive Signalwege im Dünndarm. (10) Die GLP-2-Achse ist in Abbildung 5 schematisch dargestellt. (11)
Teduglutid (Revestive®)
In Europa ist Teduglutid (Revestive®), ein Analogon von Glucagon-like Peptide 2 (GLP-2), die derzeit einzige zugelassene hormonelle Therapie des Kurzdarmsyndroms bei Erwachsenen und Kindern ab dem Alter von einem Jahr. (1) Teduglutid ist wie GLP-2 ein Peptid aus 33 Aminosäuren, bei dem im Vergleich zu GLP-2 Alanin an der zweiten Position des N-Terminus durch Glycin ersetzt wurde. Dieser Austausch macht Teduglutid resistent gegen den Abbau durch das Enzym Dipeptidyl-Peptidase-4 (DPP-4) und verlängert die Halbwertszeit im Vergleich zu GLP-2. (1)
Teduglutid zeigte in einigen präklinischen Studien folgende Effekte:
- Zunahme der Darmzottenhöhe und der Darmkryptentiefe, dadurch
- Förderung der Wiederherstellung und des normalen Darmwachstums. (1)
In klinischen Studien wurden mit Teduglutid folgende Effekte erzielt:
- verbesserte Resorption von Makronährstoffen und Elektrolyten,
- verringerte stomale oder fäkale Flüssigkeits- und Makronährstoffausscheidung und
- verbesserte strukturelle und funktionelle Anpassung der Darmmukosa. Strukturelle Anpassungen waren von vorübergehender Natur. Innerhalb von drei Wochen nach Abbruch der Therapie war wieder der ursprüngliche Zustand erreicht. (1)
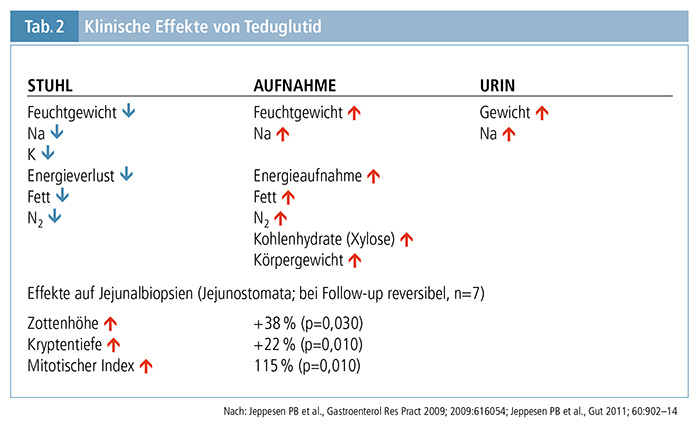
Eine Übersicht über die klinischen Effekte von Teduglutid findet sich in Tabelle 2. (12,13)
Datenlage
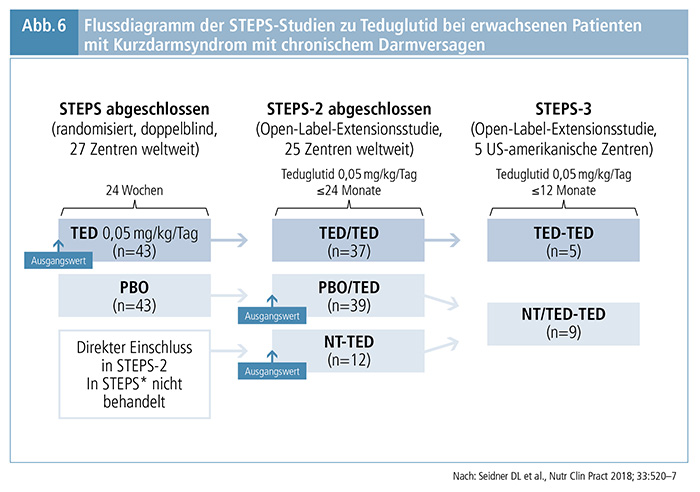
Die Wirksamkeit und Sicherheit von Teduglutid wurde im Rahmen der multinationalen Phase-III Studie 004 (13) und der STEPS-Studie (14) sowie den Langzeitstudien Studie 005 (15), STEPS-2 (16) und STEPS-3 (17) nachgewiesen (Flussdiagramm der STEPS-Studien siehe Abbildung 6 [17]).
Wirksamkeit: In die Phase-III-Studie 004 (13) und die STEPS-Studie (14) wurden Patienten ab dem Alter von 18 Jahren mit Darmversagen aufgrund eines Kurzdarmsyndroms nach Darmresektion und einer durchgängigen, mindestens 12-monatigen PS-Abhängigkeit (PS ≥3-mal pro Woche) ein geschlossen. Beide Studien umfassten eine Screening-Phase (≤7 Tage), eine PS-Optimierungsphase (bis zu 8 Wochen), eine PS-Stabilisierungsphase (4–8 Wochen) und eine Therapiephase (24 Wochen). Patienten, die in der Optimierungsphase eine Ziel-Urinausscheidung von 1,0–2,0 l erreichten, traten in die PS-Stabilisierungsphase ein. Patienten, bei denen der Urinausscheidungszielwert während der Stabilisierungsphase gehalten werden konnte, wurden für die folgende Therapiephase über 24 Wochen zu Teduglutid 0,05 mg/kg/Tag oder Placebo randomisiert. Ein Weaning erfolgte, wenn das 48-Stunden-Harnvolumen den Ausgangswert um >10 % überschritt, unabhängig vom Absolutwert. (13,14)
Alle Patienten, welche die 24-wöchige Therapiephase mit Teduglutid beendeten, konnten in die Extensionsstudien Studie 005 (15) aufgenommen werden. In STEPS-2 (16) wurden Patienten aufgenommen, die in der initialen Placebo-kontrollierten Studie Teduglutid/Teduglutid oder Placebo/Teduglutid erhalten hatten oder sich für die Studie qualifiziert hatten, aber nicht mehr in die Studie aufgenommen werden konnten, da die Einschlussphase bereits beendet war. In der Folge sind nur die Daten des STEPS-Studienprogramms dargestellt.
Teduglutid über 24 Wochen (STEPS) (14): In der 24-wöchigen STEPS-Studie wurden jeweils 43 Patienten
- zu Teduglutid 0,05 mg/kg/Tag s.c. einmal täglich oder
- Placebo einmal täglich randomisiert.
Das Durchschnittsalter lag bei 50,3 Jahren (18– 82 Jahre) und die durchschnittliche PS-Dauer bei 6,3 Jahre (1,0–25,8 Jahre). Primärer Wirksamkeitsendpunkt war die Responderrate, definiert als Anteil der Patienten mit ≥20 %iger Reduktion des wöchentlichen PS- Volumens vom Ausgangswert zu Woche 20 und Woche 24. (14)
Folgende Vorteile für Teduglutid im Vergleich zu Placebo wurden gezeigt:
- Responderrate: 63 vs. 30 % (p=0,002). Die Ansprechrate auf Teduglutid schien von der Dünndarmlänge unabhängig zu sein. Die Responderraten waren numerisch höher bei Patienten mit Kolon-Kontinuität, der Unterschied erreichte aber keine statistische Signifikanz. (14)
- PS-Volumen zu Woche 24 (sekundärer Endpunkt): –32 vs. –21 %. Der Unterschied zur Placebo-Gruppe war von Woche 12 (p=0,028) bis Woche 24 (p=0,030) signifikant. Teduglutid reduzierte das durchschnittliche PE-Infusionsvolumen signifikant um 4,4 l/Woche, verglichen mit einer Reduktion von 2,3 l/Woche bei Placebo Verabreichung. (14)
- Responserate zu Woche 24 (sekundärer exploratorischer Endpunkt): 77 vs. 46 % (p=0,01) (14)
- Patienten mit ≥ 1 Tag weniger PS-Bedarf pro Woche (sekundärer exploratorischer Endpunkt): 54 vs. 23 % (p=0,005). Insgesamt 53 % der mit Teduglutid behandelten Patienten vs. 23 % der mit Placebo Behandelten erreichten eine Reduktion von mindestens einem PETag pro Woche. (14)
- Zusammengesetzter Flüssigkeitseffekt (fluid composite endpoint, FCE: PS-Volumenreduktion plus Reduktion der oralen Flüssigkeitsaufnahme plus erhöhtes Harnvolumen): 5,4 vs. 1,1 l/Woche (p<0,0006). (14)
Langzeittherapie mit Teduglutid (STEPS-2 (16), STEPS-3 [17]) Die Therapieeffekte von
Teduglutid 0,05 mg/kg/Tag konnten langfristig aufrechterhalten werden. In die STEPS-2-Studie (16) wurden Patienten der Teduglutid-Gruppe und der Placebo-Gruppe aufgenommen, welche die 24-wöchige STEPS-Studie abgeschlossen hatten (TED/TED, PBP/TED), sowie Patienten, die sich für die STEPS-Studie qualifiziert hatten, aber aufgrund des Einschlussendes nicht therapiert wurden (NT/TED).
Die Patienten erhielten Teduglutid 0,05 mg/ kg/Tag über bis zu 30 Monate (TED/TED) bzw. über bis zu 24 Monate (NT/TED und PBO/TED). Klinische Response war definiert als Reduktion des PS-Volumens um 20–100 % vom Ausgangswert (Ausgangswert der STEPS-Studie für die TED/TED-Gruppe, Ausgangswert der STEPS-2- Studie für die Gruppen PBO/TED und NT/TED). (16) 65 der eingeschlossenen 88 Patienten (74 %) beendeten die STEPS-2-Studie. Die Ergebnisse für die klinische Response und die durchschnittliche Reduktion des PS-Volumens vom Ausgangswert:
- TED/TED-Gruppe: 93 % (28/30 Patienten); –7,6 l/ Woche (–66 %)
- PBO/TED-Gruppe: 55 % (16/29 Patienten); – 3,1 l/ Woche (–28 %)
- NT/TED-Gruppe: 67 % (4/6 Patienten; –4,0 l/ Woche (–39 %). (16)
15 Patienten erreichten eine vollständige entera le Autonomie und konnten somit die PS komplett absetzen. Gesundheits- und Ernährungsstatus blieben trotz der PS-Reduktion erhalten. (16) Mittlerweile liegen die Daten der STEPS-3- Studie (17) vor. In diese einjährige Open-Label-Extensionsstudie wurden US-amerikanische Patienten aufgenommen, welche die STEPS-2-Studie abgeschlossen hatten. Ausgangswert war die STEPS- oder die STEPS-2-Studie. Damit liegen zu Patienten, die von Beginn an Teduglutid erhalten hatten, Daten über bis zu 42 Monate vor und zu Patienten, die erst in der STEPS-2-Studie Teduglutid erhalten hatten, Daten über bis zu 36 Monate. Insgesamt 14 Patienten wurden in die STEPS-3- Studie eingeschlossen (TED–TED, n=5; NT/PBO– TED, n=9) und 13 Patienten beendeten STEPS-3.
Die Ergebnisse bei der Visite im Rahmen der letzten Teduglutid-Gabe:
- Reduktion des durchschnittlichen PS-Volumens in der TED/TED-Gruppe: 9,8 l/Woche (–50 %) und in der NT/PBO-TED-Gruppe: 3,9 l/ Woche (–48 %)
- Reduktion der Tage mit PS-Infusion: –3,0 bzw. –2,1 Tage
- Zwei Patienten wurden völlig von PS unabhängig.
- Zwei weitere Patienten, die bereits in der STEPS2-Studie unabhängig geworden waren, blieben es auch während der STEPS-3-Studie. (17)
Sicherheit und Verträglichkeit
Teduglutid 0,05 mg/kg/Tag wurde generell gut vertragen. Die meisten unerwünschten Ereignisse (UE) waren mild oder mäßig ausgeprägt und entsprachen der Grunderkrankung oder den bekannten Effekten von Teduglutid. In einer gepoolten Analyse der Studie 004 und der STEPS Studie wurden bei 88,3 % der mit Teduglutid behandelten Patienten und bei 83,1 % der mit Placebo behandelten Patienten UE dokumentiert. UE, die bei ≥5 % der Patienten auftraten und unter Teduglutid ≥1,5-mal häufiger waren als unter Placebo waren Blähungen, Stoma-Komplikationen, Nasopharyngitis, periphere Ödeme, Katheter- assoziierte Infektionen, Appetitmangel, Katheter sepsis, Oberbauchschmerzen und Influenza. Auch Erytheme an der Injektionsstelle waren in der Teduglutid-Gruppe häufiger, traten aber bei weniger als 5 % der Patienten auf. Schwere UE wurden bei 32,5 % der mit Teduglutid 0,05 mg/kg/Tag behandelten Patienten und bei 27,1 % der mit Placebo behandelten Patienten berichtet. (18)
10,4 % der Patienten des Teduglutid-Arms und 6,8 % der Patienten des Placebo-Arms brachen die Therapie aufgrund von UE ab. In den Placebo-kontrollierten Teduglutid-Studien ereignete sich kein Todesfall. (18)
Der häufigste in den Teduglutid-Studien veränderte Laborparameter war CRP (Teduglutid: 24 %, Placebo: 8,6 %); Veränderungen der Leberfunktionsparameter und von Albumin waren unter Teduglutid und Placebo vergleichbar. (18)
Es wurden keine neuen Nebenwirkungen bei Patienten festgestellt, die 0,05 mg/kg/Tag Teduglutid für bis zu 30 Monate im Rahmen einer offenen Langzeit-Verlängerungsstudie erhielten. (1)
In den Schlüsselstudien entwickelte rund ein Viertel der Patienten nach einem Jahre Antikörper. Diese waren aber nicht mit relevanten Effekten auf die Wirksamkeit oder Sicherheit assoziiert. (18)
Ob Teduglutid das Risiko für die Entstehung von Neoplasien im Dünndarm und/oder Kolon erhöht, konnte in klinischen Studien weder ausgeschlossen noch bestätigt werden. (1)
Real-Life-Daten (19, 20): Zu Teduglutid liegen erste Daten einer retrospektiven französischen Multicenterstudie zur Anwendung unter Alltagsbedingungen vor. Eingeschlossen wurden konsekutive Patienten mit Kurzdarmsyndrom, die Teduglutid über mindestens drei Monate erhalten hatten.
Im Folgenden die Auswertung der Daten von 42 Patienten (Durchschnittsalter 52,3 Jahre, durchschnittliche PS-Dauer 9,8 Jahre, durchschnittliche Dünndarmlänge 55 cm):
Die Ergebnisse zu Woche 12 (19):
- Volumenreduktion um ≥20 %: 25/42 Patienten (59,5 %) (sehr frühe Responder); bei 13/42 Patienten war das Ausmaß des PS unverändert
- sehr frühe Entwöhnung von PS: 9/42; sehr Responder waren Patienten mit einer signifikant höheren oralen Kalorienaufnahme zu Basline (19).
Die Ergebnisse zu Woche 24 (20):
- Responder: 46/54 Patienten (85 %; durchschnittlich 2,8 PS-Tage/Woche
- PS-Entwöhnung: 13/54 Patienten (ca. 25 %). (20)
Faktoren für das Ansprechen
Als Prädiktoren für ein Ansprechen auf Teduglutid identifizierten Jeppesen et al. (21) anhand
einer retrospektiven Analyse von Daten einer Phase-III- Studie bei Patienten mit Morbus Crohn (frühes Ansprechen)
- hohes Ausgangs-PS-Volumen,
- Vorliegen eines Stomas und
- ohne Kolon in Kontinuität.
Bei Patienten mit vaskulären Erkrankungen waren die Prädiktoren für ein Ansprechen auf Teduglutid (spätes Ansprechen)
- niedriges Ausgangs-PS-Volumen
- kein Stoma
- Kolon in Kontinuität ≥50 %. (21)
Leitlinienempfehlung
ESPEN empfiehlt in ihren Guidelines, Patienten über GLP-2-Analoga zur intestinalen Rehabilitation/Adaptationsförderung zu informieren. Für Patienten, die geeignet für eine Wachstumshormontherapie sind, ist Teduglutid als erste Wahl empfohlen. (5)
Gemäß der S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin e. V. in Zusammenarbeit mit der AKE, der GESKES und der DGVS sollte Teduglutid bei Patienten mit einem stabil infusionspflichtigen Darmversagen eingesetzt werden, mit dem Ziel, infusionsfreie Tage zu gewinnen. (22)
Anwendung von Teduglutid in der Praxis (1)
Teduglutid ist zur Behandlung von Patienten ab dem Alter von einem Jahr mit Kurzdarmsyndrom zugelassen. Nach einem chirurgischen Eingriff sollte zunächst eine Phase der intestinalen Adaption abgewartet werden, und die Patienten sollten sich in einer stabilen Phase befinden. (1)
Dokumentation Bei jeder Anwendung von Teduglutid sollte der Patientenname und die Chargenbezeichnung dokumentiert werden. (1)
Verabreichung/Dosierung:
Teduglutid wird subkutan appliziert.
- Kinder, Jugendliche (1–17 Jahre) und Erwachsene: 0,05 mg/kg Körpergewicht 1-mal täglich
- Wenn eine Dosis ausgelassen wird, sollte die Injektion so bald wie möglich am selben Tag nachgeholt werden.
- Teduglutid vorsichtig absetzen (Risiko der Dehydrierung) (1)
Vorsicht ist geboten bei
- Patienten mit bekannter Überempfindlichkeit gegenüber Tetracyclin
- Patienten mit schwerwiegenden, klinisch instabilen Begleiterkrankungen (z. B. kardiovaskuläre, respiratorische, renale, infektiöse, endokrine, hepatische oder ZNS-Erkrankungen) oder mit einer Krebserkrankung in den letzten fünf Jahren (nicht untersucht) (1)
Maßnahmen vor Therapiebeginn
- Optimierung und Stabilisierung der intravenösen Flüssigkeits- und Nahrungszufuhr
-
Koloskopie zur Entfernung von Darmpolypen
(Erwachsene, Kinder mit unerklärlichem Blut im Stuhl), Untersuchung auf okkultes Blut im Stuhl (Kinder, Jugendliche) (1)
Maßnahmen während der Therapie
- vorsichtige Reduktion der PS, Anpassung des Flüssigkeitsstatus
- sorgfältige Überwachung einer oralen Begleitmedikation (evtl. erhöhte Resorption)
- Kontrollkoloskopie (oder eine andere bildgebende Untersuchung): in den ersten beiden Therapiejahren jährlich, dann mindestens alle fünf Jahre
- Kontrollen der Funktion des Dünndarms, der Gallenblase, der Gallengänge und des Pankreas auf bestimmte Anzeichen und Symptome, gegebenenfalls Laboruntersuchungen und Bildgebung
- Kontrolle von Patienten mit kardiovaskulären Erkrankungen hinsichtlich Flüssigkeitsretention (engmaschige Kontrollen v. a. zu Therapiebeginn) (1)
Beendigung der Therapie
- bei ausbleibender allgemeiner Verbesserung des Zustandes
- bei Auftreten einer Malignität (1)
Reevaluierung der Fortsetzung der Therapie bei
- Symptomen der Gallenblase oder der Gallengängen
- Pankreas-assoziierten UE
- rezidivierendem Darmverschluss
- signifikanter Verschlechterung einer kongestiven Herzinsuffizienz (1)
Schwangerschaft/Stillzeit
- keine/wenige Daten, Anwendung von Teduglutid vermeiden (1)
Weitere Materialien zum Download
REFERENZEN
(1) Revestive®-Fachinformation (2) Orphanet Report Series Rare Disease Collection Prevalence of rare diseases: Bibliographic data June 2018 https://www.orphanet/orphacom/cahiers/docs/GB/Prevalence_ of_rare_diseases_by_alphabetical_listpdf (3) Jeppesen PB JPEN J Parenter Enteral Nutr 2014; 38:8–13 (4) Messing B et al., Gastroenterology 1999; 117:1043–50 (5) Pironi L et al., Clin Nutr 2016; 35:247–307 (6) Jeppesen PB Expert Opinion on Orphan Drugs 2013; 1:515–25 (7) Jeppesen PB Diagnosing and Treating Short Bowel Syndrome with Intestinal Failure: an Update CPD, https://www.medscapeorg/viewarticle/892117_print, abgerufen 2492018 (8) Jeppesen PB in DiBaise, J K Short Bowel Syndrome: Practical Approach to Management:ISBN 9781498720786 – CAT# K25548 (9) Jeppesen PB Therap Adv Gastroenterol 2012; 5:159–71 (10) Drucker DJ et al., Annu Rev Physiol 2014; 76:561–83 (11) Sigalet DL J Anim Sci 2012; 90:1224–32 (12) Jeppesen PB et al., Gastroenterol Res Pract 2009; 2009:616054 (13) Jeppesen PB et al., Gut 2011; 60:902–14 (14) Jeppesen PB et al., Gastroenterology 2012; 143:1473–81 e3 (15) O‘Keefe SJ et al., Clin Gastroenterol Hepatol 2013; 11:815–23 e1–3 (16) Schwartz LK et al., Clin Transl Gastroenterol 2016; 7:e142 (17) Seidner DL et al., Nutr Clin Pract 2018; 33:520–7 (18) European Medicines Agency Revestive: EPAR-public assessment report 2012 http://www.emaeuropaeu Accessed 31 Jan 2017 (19) Joly F et al., CIRTA 2017: Abstract 210.2 (20) Joly F et al., JFN 2017:Oral presentation (21) Jeppesen PB et al., Gastroenterology 2018; 154:874–85 (22) Lamprecht G et al., Aktuel Ernahrungsmed 2014; 39:e57–e71
FACHKURZINFORMATION
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation. Revestive 1,25 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Revestive 5 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Pharmakotherapeutische Gruppe: Andere Mittel für das alimentäre System und den Stoffwechsel, sonstige Mittel für das alimentäre System und den Stoffwechsel, ATC-Code: A16AX08. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG: Eine Durchstechflasche mit Pulver enthält 1,25 mg Teduglutid*. Nach Rekonstitution enthält jede Durchstechflasche 1,25 mg Teduglutid in 0,5 ml Lösung, entsprechend einer Konzentration von 2,5 mg/ml. Eine Durchstechflasche mit Pulver enthält 5 mg Teduglutid*. Nach Rekonstitution enthält jede Durchstechflasche 5 mg Teduglutid in 0,5 ml Lösung, entsprechend einer Konzentration von 10 mg/ml. *Analog des Glucagon like Peptids 2 (GLP 2), hergestellt in Escherichia coli Zellen mittels rekombinanter DNA-Technologie. Liste der sonstigen Bestandteile: Pulver: L Histidin, Mannitol, Natriumdihydrogenphosphat 1 H2O, Dinatriumhydrogenphosphat 7 H2O. Lösungsmittel: Wasser für Injektionszwecke. ANWENDUNGSGEBIETE: Revestive wird angewendet zur Behandlung von Patienten ab dem Alter von 1 Jahr mit Kurzdarmsyndrom (KDS). Nach einem chirurgischen Eingriff sollte zunächst eine Phase der intestinalen Adaption abgewartet werden und die Patienten sollten sich in einer stabilen Phase befinden. GEGENANZEIGEN: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 der Fachinformation genannten sonstigen Bestandteile oder gegen das in Spuren vorhandene Tetracyclin. Aktive oder vermutete Krebserkrankung (Malignität). Patienten mit einer anamnestisch bekannten malignen Erkrankung des Gastrointestinaltraktes, einschließlich des hepatobiliären Systems und des Pankreas, in den vergangenen fünf Jahren. INHABER DER ZULASSUNG: Shire Pharmaceuticals Ireland Limited, Block 2 & 3 Miesian Plaza, 50–58 Baggot, Street Lower, Dublin 2, Irland. STAND DER INFORMATION: 12/2017. REZEPTPFLICHT/APOTHEKENPFLICHT: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Weitere Angaben zu “Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“, „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“, „Fertilität, Schwangerschaft und Stillzeit“, „Nebenwirkungen“ und „Gewöhnungseffekte“ sind der veröffentlichten Fachinformation zu entnehmen.
C-APROM/AT//0933
IMPRESSUM: Expertenmeinung ist eine Publikation von MEDahead, Gesellschaft für medizinische Information m.b.H., 1070 Wien, Seidengasse 9/Top 1.3, office@medahead.at. Für den Inhalt verantwortlich: MEDahead, Redaktion: Dr. Claudia Uhlir. Hinweis: Diese Publikation ist für Angehörige von Gesundheitsberufen zugänglich und dient deren Fortbildung. Die in dieser Publikation dargestellten Empfehlungen stellen das Wissen und die Erfahrungen der teilnehmenden Ärzte dar. Angaben über Dosierungen, Applikationsformen und Indikationen von pharmazeutischen Spezialitäten entnehmen Sie bitte der aktuellen österreichischen Fachinformation. Trotz sorgfältiger Prüfung übernimmt der Medieninhaber keinerlei Haftung für inhaltliche oder drucktechnische Fehler. Die in dieser Publikation verwendeten Personen- und Berufsbezeichnungen treten der besseren Lesbarkeit halber nur in einer Form auf, sind aber natürlich gleichwertig auf beide Geschlechter bezogen. Alle Rechte, insbesondere das Recht der Vervielfältigung und Verbreitung sowie der Übersetzung, vorbehalten. Kein Teil des Werkes darf in irgendeiner Form (Fotokopie, Mikrofilm oder ein anderes Verfahren) ohne schriftliche Genehmigung des Verlages reproduziert oder unter Verwendung elektronischer Systeme gespeichert, verarbeitet, vervielfältigt, verwertet oder verbreitet werden. Die vorliegende Publikation wurde durch die finanzielle Unterstützung der Firma Shire Austria GmbH ermöglicht.